[ad_1]
Un atome est mieux visualisé comme un noyau serré et dense entouré d’électrons bourdonnants et en orbite. Cette image amène immédiatement à une question : comment les électrons continuent-ils à tourner autour du noyau sans jamais ralentir ?
C’était une question brûlante au début du XXe siècle, et la recherche de la réponse a finalement conduit au développement de mécanique quantique lui-même.
Au début du XXe siècle, après d’innombrables expériences, les physiciens commençaient tout juste à dresser un tableau cohérent de la atome. Ils ont réalisé que chaque atome avait un noyau dense, lourd et chargé positivement entouré d’un nuage de minuscules électrons chargés négativement. Avec cette image générale à l’esprit, leur prochaine étape consistait à créer un modèle plus détaillé.
Lié: Des « molécules gravitationnelles » étranges pourraient orbiter autour de trous noirs comme des électrons tourbillonnant autour d’atomes
Dans les premières tentatives de ce modèle, les scientifiques se sont inspirés de la système solairequi a un « noyau » dense (le Soleil) entouré d’un « nuage » de particules plus petites (les planètes). Mais ce modèle a introduit deux problèmes importants.
D’une part, une particule chargée qui accélère émet un rayonnement électromagnétique. Et parce que les électrons sont des particules chargées et qu’ils accélèrent pendant leurs orbites, ils devraient émettre un rayonnement. Cette émission entraînerait une perte d’énergie des électrons et une spirale et une collision rapides avec le noyau, selon l’Université du Tennessee à Knoxville (s’ouvre dans un nouvel onglet). Au début des années 1900, les physiciens estimaient qu’une telle spirale intérieure prendrait moins d’un billionième de seconde, ou une picoseconde. Puisque les atomes vivent évidemment plus longtemps qu’une picoseconde, cela n’allait pas fonctionner.
Un deuxième problème, plus subtil, concernait la nature du rayonnement. Les scientifiques savent que les atomes émettent des radiations, mais ils le font à des fréquences spécifiques très discrètes. Un électron en orbite, s’il suivait ce modèle du système solaire, émettrait plutôt toutes sortes de longueurs d’onde, contrairement aux observations.
La solution quantique
Le célèbre physicien danois Niels Bohr a été le premier à proposer une solution à ce problème. En 1913, il a suggéré que les électrons dans un atome ne pouvaient pas avoir n’importe quelle orbite qu’ils voulaient. Au lieu de cela, ils devaient être verrouillés sur des orbites à des distances très spécifiques du noyau, selon l’entrée de citation du prix Nobel pour son prix ultérieur (s’ouvre dans un nouvel onglet). De plus, il a proposé qu’il y avait une distance minimale qu’un électron pouvait atteindre et qu’il ne pouvait pas se rapprocher du noyau.
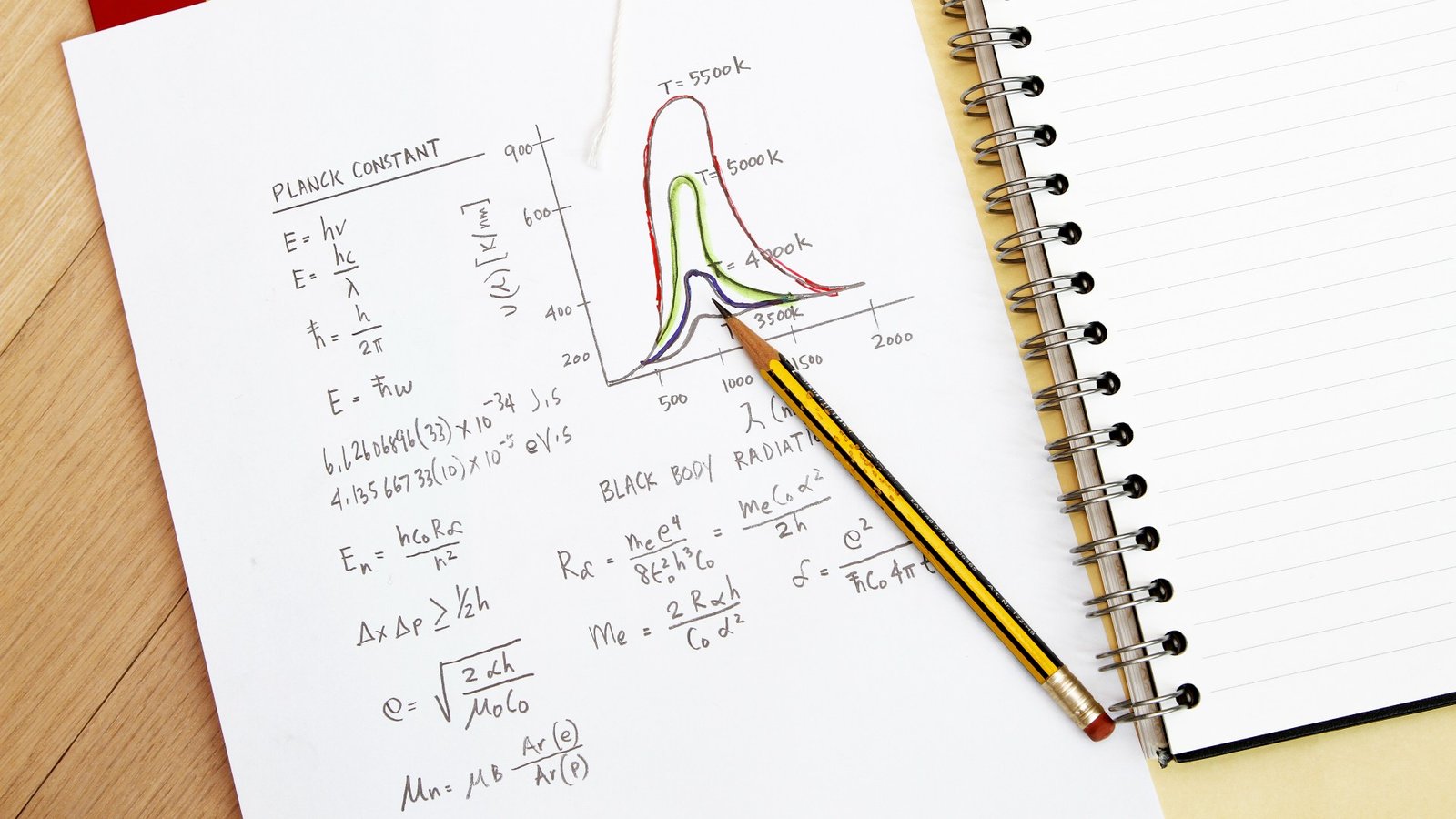
Il n’a pas simplement sorti ces idées d’un chapeau. Un peu plus d’une décennie auparavant, le physicien allemand Max Planck avait proposé que l’émission de rayonnement puisse être « quantifiée », ce qui signifie qu’un objet ne pouvait absorber ou émettre un rayonnement que par morceaux discrets, et n’avait aucune valeur qu’il voulait, selon la page de référence HyperPhysics de la Georgia State University (s’ouvre dans un nouvel onglet). Mais la plus petite taille de ces morceaux discrets était une constante, connue sous le nom de constante de Planck. Avant cela, les scientifiques pensaient que ces émissions étaient continues, ce qui signifie que les particules pouvaient rayonner à n’importe quelle fréquence.
La constante de Planck a les mêmes unités que le moment cinétique ou le moment d’un objet se déplaçant dans un cercle. Bohr a donc importé cette idée aux électrons en orbite autour d’un noyau, en disant que la plus petite orbite possible d’un électron serait égale au moment cinétique d’exactement une constante de Planck. Des orbites plus élevées pourraient avoir deux fois cette valeur, ou trois fois, ou tout autre multiple entier de la constante de Planck, mais jamais une fraction de celle-ci (donc pas 1,3 ou 2,6 et ainsi de suite).
Il faudrait le développement complet de la mécanique quantique pour comprendre pourquoi les électrons avaient une orbite aussi minimale et des orbites supérieures clairement définies. Les électrons, comme toutes les particules de matière, se comportent à la fois comme des particules et comme des ondes. Alors que nous pourrions imaginer un électron comme une petite planète en orbite autour du noyau, nous pouvons tout aussi bien l’imaginer comme une onde enroulée autour de ce noyau.
Les vagues dans un espace confiné doivent obéir à des règles particulières. Ils ne peuvent pas avoir n’importe quelle longueur d’onde; ils doivent être constitués d’ondes stationnaires qui s’insèrent dans l’espace. C’est comme quand quelqu’un joue d’un instrument de musique : si vous épinglez les extrémités d’une corde de guitare, par exemple, seules certaines longueurs d’onde conviendront, vous donnant les notes séparées. De même, l’onde électronique autour d’un noyau doit s’adapter, et l’orbite la plus proche pour un électron d’un noyau est donnée par la première onde stationnaire de cet électron.
Les développements futurs de la mécanique quantique continueraient à affiner cette image, mais le point fondamental demeure : un électron ne peut pas se rapprocher d’un noyau car sa nature mécanique quantique ne lui permet pas de prendre moins de place.
Additionner les énergies
Mais il existe une manière complètement différente d’examiner la situation qui ne repose pas du tout sur la mécanique quantique : il suffit de regarder toutes les énergies impliquées. Un électron en orbite autour d’un noyau est électriquement attiré par le noyau ; il est toujours rapproché. Mais l’électron a aussi de l’énergie cinétique, qui fonctionne pour envoyer l’électron s’envoler.
Pour un atome stable, ces deux sont en équilibre. En fait, l’énergie totale d’un électron en orbite, qui est une combinaison de sa cinétique et énergies potentielles, est négatif. Cela signifie que vous devez ajouter de l’énergie à l’atome si vous voulez supprimer l’électron. C’est la même situation avec les planètes en orbite autour du soleil : pour retirer une planète du système solaire, il faudrait ajouter de l’énergie au système.
Une façon de voir cette situation est d’imaginer un électron « tombant » vers un noyau, attiré par sa charge électrique opposée. Mais à cause des règles de la mécanique quantique, il ne peut jamais atteindre le noyau. Alors il reste bloqué, en orbite pour toujours. Mais ce scénario est autorisé par la physique, car l’énergie totale du système est négative, ce qui signifie qu’il est stable et lié, formant un atome de longue durée.
Publié à l’origine sur Live Science le 21 janvier 2011 et réécrit le 22 juin 2022.
[ad_2]
Source link