[ad_1]
La thérapie génique a fait la une des journaux ces dernières années, en partie à cause du développement rapide de la biotechnologie qui permet aux médecins d’administrer de tels traitements. De manière générale, les thérapies géniques sont des techniques utilisées pour traiter ou prévenir les maladies en modifiant le contenu ou l’expression de l’ADN des cellules, souvent en remplaçant les gènes défectueux par des gènes fonctionnels.
Le terme « thérapie génique » apparaît parfois à côté de la désinformation sur les vaccins à ARNm, qui incluent le Pfizer et le Moderna Vaccins contre le covid-19. Ces vaccins contiennent de l’ARNm, un cousin génétique de l’ADN, qui incite les cellules à fabriquer la « protéine de pointe » du coronavirus. Les vaccins ne modifient pas l’ADN des cellules, et après avoir fait le pic, les cellules décomposent la majeure partie de l’ARNm. D’autres injections de COVID-19 incluent les vaccins à vecteur viral fabriqués par AstraZeneca et Johnson & Johnson, qui délivrent de l’ADN dans les cellules pour leur faire construire des protéines de pointe. Les cellules qui fabriquent les protéines de pointe, en utilisant les instructions de l’ARNm ou des vaccins à vecteur viral, servent de pratique cible pour le système immunitaire, de sorte qu’elles ne restent pas longtemps. C’est très, très différent de la thérapie génique, qui vise à modifier la fonction des cellules à long terme.
Plongeons dans ce qu’est la thérapie génique en fait c’est-à-dire répondre à certaines questions courantes en cours de route.
Qu’est-ce que la thérapie génique et que fait-elle à votre ADN ?
ADN est une molécule qui stocke l’information génétique, et les gènes sont des éléments d’information génétique que les cellules utilisent pour fabriquer un produit particulier, comme une protéine. L’ADN est situé à l’intérieur du noyau d’une cellule, où il est emballé dans des chromosomes, ainsi qu’à l’intérieur des mitochondries, les organites « centrales » situées à l’extérieur du noyau.
Bien qu’il existe des maladies mitochondriales qui pourraient un jour être guéries avec la thérapie génique, actuellement, le terme thérapie génique fait référence aux traitements qui ciblent les gènes nucléaires – les gènes sur les 23 paires de chromosomes à l’intérieur du noyau.
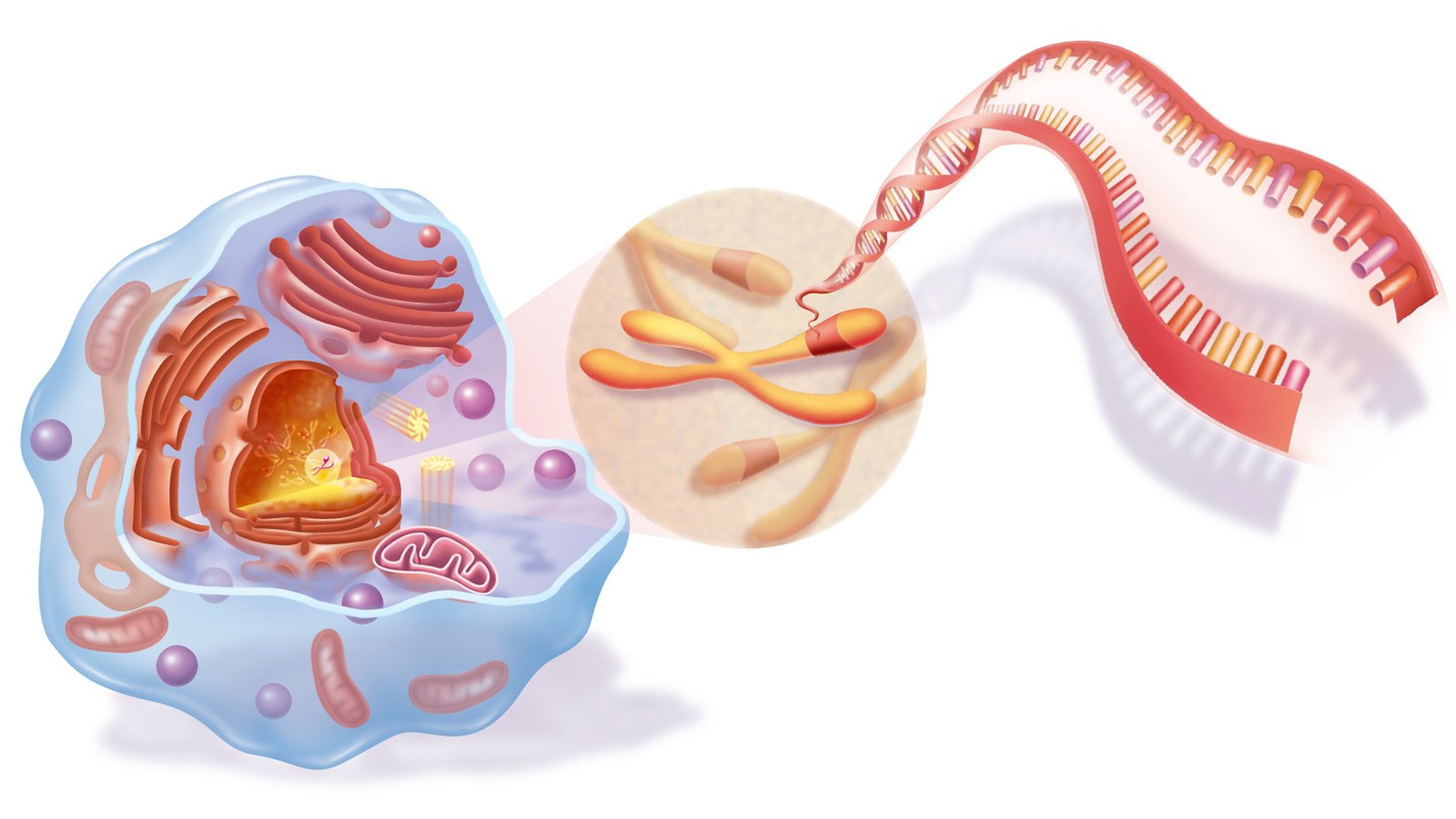
Classiquement, la thérapie génique fait référence au processus consistant soit à « éliminer » un gène dysfonctionnel, soit à ajouter une copie d’un gène fonctionnel au noyau afin d’améliorer la fonction cellulaire. La thérapie génique s’adresse actuellement aux maladies issues d’un problème avec un seul gène, ou tout au plus quelques gènes, plutôt qu’à celles qui impliquent de nombreux gènes.
Cependant, le domaine de la thérapie génique s’élargit maintenant pour inclure des stratégies qui ne relèvent pas toutes des catégories classiques d’élimination des mauvais gènes ou d’ajout de bons gènes. Par exemple, les chercheurs de Sangamo Therapeutics développent des techniques génétiques pour le traitement des maladies de Parkinson, d’Alzheimer et de Huntington qui fonctionnent en augmentant ou en supprimant l’activité de gènes spécifiques.
Alors que les traitements peuvent ajouter des gènes aux cellules du corps, éliminer des gènes ou agir d’une manière ou d’une autre pour modifier la fonction des gènes, chaque thérapie génique est dirigée vers les cellules de tissus corporels particuliers. Ainsi, lorsque les scientifiques et les médecins parlent des effets de la thérapie génique sur l’ADN, ils ne parlent pas de tout l’ADN du corps, mais seulement d’une partie.
Comment fonctionne la thérapie génique ?
La thérapie génique peut être soit ex vivo or en direct.
ex vivo la thérapie génique signifie que les cellules sont retirées du corps, traitées puis réintroduites dans le corps. C’est l’approche utilisée pour traiter les maladies génétiques des cellules sanguines, car la moelle osseuse peut être prélevée sur le patient, les cellules souches de cette moelle osseuse peuvent être traitées par thérapie génique – par exemple, pour fournir un gène manquant ou qui ne fonctionne pas correctement — et les cellules transformées peuvent être réinfusées au patient.

In vivo la thérapie génique signifie que la thérapie génique elle-même est injectée ou perfusée à la personne. Cela peut se faire par injection directement sur le site anatomique où la thérapie génique est nécessaire (un exemple courant étant la rétine de l’œil), ou cela peut signifier l’injection ou l’infusion d’une charge utile génétique qui doit se déplacer vers les tissus corporels où elle est nécessaire. .
À la fois ex vivo et en direct thérapie génique, la charge utile génétique est conditionnée dans un conteneur, appelé vecteur, avant d’être délivrée dans les cellules ou le corps. Un tel vecteur est le virus adéno-associé (AAV). Il s’agit d’un groupe de virus qui existent dans la nature mais dont les gènes habituels ont été retirés et remplacés par une charge utile génétique, les transformant en vecteurs de thérapie génique.
La thérapie génique est-elle sûre ?
L’AAV est utilisé pour administrer la thérapie génique depuis de nombreuses années, car il a un bon dossier de sécurité. Il est beaucoup moins susceptible de provoquer une réponse immunitaire dangereuse que d’autres virus utilisés comme vecteurs il y a plusieurs décennies, lorsque la thérapie génique ne faisait que commencer. De plus, le conditionnement des charges utiles génétiques dans les porteurs d’AAV permet à la thérapie génique injectée ou infusée de se déplacer vers des tissus corporels particuliers là où elle est nécessaire. En effet, il existe de nombreux types d’AAV et certains types sont attirés par certains tissus ou organes. Ainsi, si une charge utile génétique doit atteindre les cellules hépatiques, par exemple, elle peut être conditionnée dans un type d’AAV qui aime aller au foie.
Aux débuts de la thérapie génique, qui a débuté en 1989, les chercheurs utilisaient des rétrovirus comme vecteurs. Ces virus ont livré une charge utile génétique directement dans les chromosomes nucléaires du patient. Cependant, on craignait qu’une telle intégration de nouvel ADN dans les chromosomes pourrait causer des changements menant au cancer (s’ouvre dans un nouvel onglet), la stratégie a donc été initialement abandonnée. (Plus récemment, des scientifiques ont utilisé avec succès des rétrovirus dans des thérapies géniques expérimentales sans provoquer de cancer ; par exemple, une thérapie à base de rétrovirus a été utilisée pour traiter les nourrissons atteints de la « maladie du garçon à bulles ».)

Après s’être éloignés des rétrovirus, les chercheurs se sont tournés vers les adénovirus, qui offraient l’avantage de fournir la charge utile génétique sous forme d’épisome – un morceau d’ADN qui fonctionne comme un gène à l’intérieur du noyau mais reste une entité distincte des chromosomes. Le risque de cancer était extrêmement faible avec cette innovation, mais les vecteurs adénoviraux se sont avérés stimuler le système immunitaire de manière très puissante. En 1999, une réaction immunitaire d’une thérapie génique porteuse d’adénovirus a conduit à la décès de Jesse Gelsinger, 18 ans, (s’ouvre dans un nouvel onglet) qui s’était porté volontaire pour un essai clinique.
La mort de Gelsinger a choqué la communauté de la thérapie génique, bloquant le domaine pendant plusieurs années, mais les thérapies géniques actuelles qui ont émergé au fil des ans sur la base de l’AAV ne sont pas dangereuses. Cependant, ils ont tendance à être coûteux et le taux de réussite varie, ils sont donc généralement utilisés en dernier recours pour un nombre croissant de maladies génétiques.
Quelles conditions sont actuellement traitées avec la thérapie génique ?
La thérapie génique peut traiter certaines maladies du sang, telles que l’hémophilie A, l’hémophilie B, la drépanocytose et à partir de 2022, la bêta-thalassémie (s’ouvre dans un nouvel onglet). Ce que ces maladies ont en commun, c’est que le problème se résume à un seul gène. Cela a fait de la bêta-thalassémie et de la drépanocytose des fruits à portée de main pour ex vivo thérapies géniques qui impliquent l’élimination et la modification des cellules souches de la moelle osseuse, tandis que l’hémophilie A et l’hémophilie B sont traitées avec en direct thérapies géniques ciblant les cellules hépatiques. Cela dit, d’autres traitements existent pour ces maladies du sang, la thérapie génique est donc plutôt un dernier recours.
De nombreux troubles de carence enzymatique se résument également à un mauvais gène qui doit être remplacé. L’adrénoleucodystrophie cérébrale, qui provoque l’accumulation d’acides gras dans le cerveau, est l’un de ces troubles qui peut être traité par thérapie génique, selon Hôpital pour enfants de Boston (s’ouvre dans un nouvel onglet). La thérapie CAR T-cell, approuvée pour certains cancers, consiste à éliminer et à modifier les cellules immunitaires d’un patient et est connue sous le nom de « thérapie génique cellulaire ». (s’ouvre dans un nouvel onglet)
La thérapie génique a également été utile dans le traitement des maladies rétiniennes héréditaires (s’ouvre dans un nouvel onglet)pour lesquels les autres traitements n’ont pas été utiles.
Quelles thérapies géniques sont en développement ?
Un autre groupe de cibles pour la thérapie génique sont les maladies du système nerveux.
« Nous sommes à un moment remarquable dans les neurosciences, où des traitements pour les formes génétiques de troubles neurologiques sont en cours de développement », Dr Merit Cudkowicz (s’ouvre dans un nouvel onglet)le chef de la neurologie au Massachusetts General Hospital et professeur à la Harvard Medical School, a déclaré à Live Science.
Par exemple, des thérapies géniques sont en cours de développement pour traiter une paire de maladies génétiques appelées maladie de Tay-Sachs et maladie de Sandhoff. Les deux conditions résultent d’organites appelées lysosomes qui se remplissent de molécules ressemblant à de la graisse appelées gangliosides. Thé effets de ces maladies (s’ouvre dans un nouvel onglet) comprennent un retard dans l’atteinte des étapes de développement, la perte des compétences acquises précédemment, la raideur, la cécité, la faiblesse et le manque de coordination avec une éventuelle paralysie. Les enfants nés avec la maladie de Tay-Sachs et la maladie de Sandhoff ne dépassent généralement pas l’âge de 2 à 5 ans.
« Il n’y a pas eu de test prénatal ou néonatal de routine pour Tay-Sachs et Sandhoff, car il n’y a eu aucun traitement disponible », a déclaré Dr Jagdeep Walia (s’ouvre dans un nouvel onglet), généticienne clinique et chef de la Division de génétique médicale au sein du Département de pédiatrie et du Centre des sciences de la santé de Kingston et de l’Université Queen’s en Ontario, Canada. Walia développe une thérapie génique visant à remplacer le gène de l’Hex A, l’enzyme déficiente chez ces enfants. Jusqu’à présent, le traitement a montré une bonne efficacité et une bonne innocuité dans des modèles animaux, mais il doit encore être testé chez des patients humains.
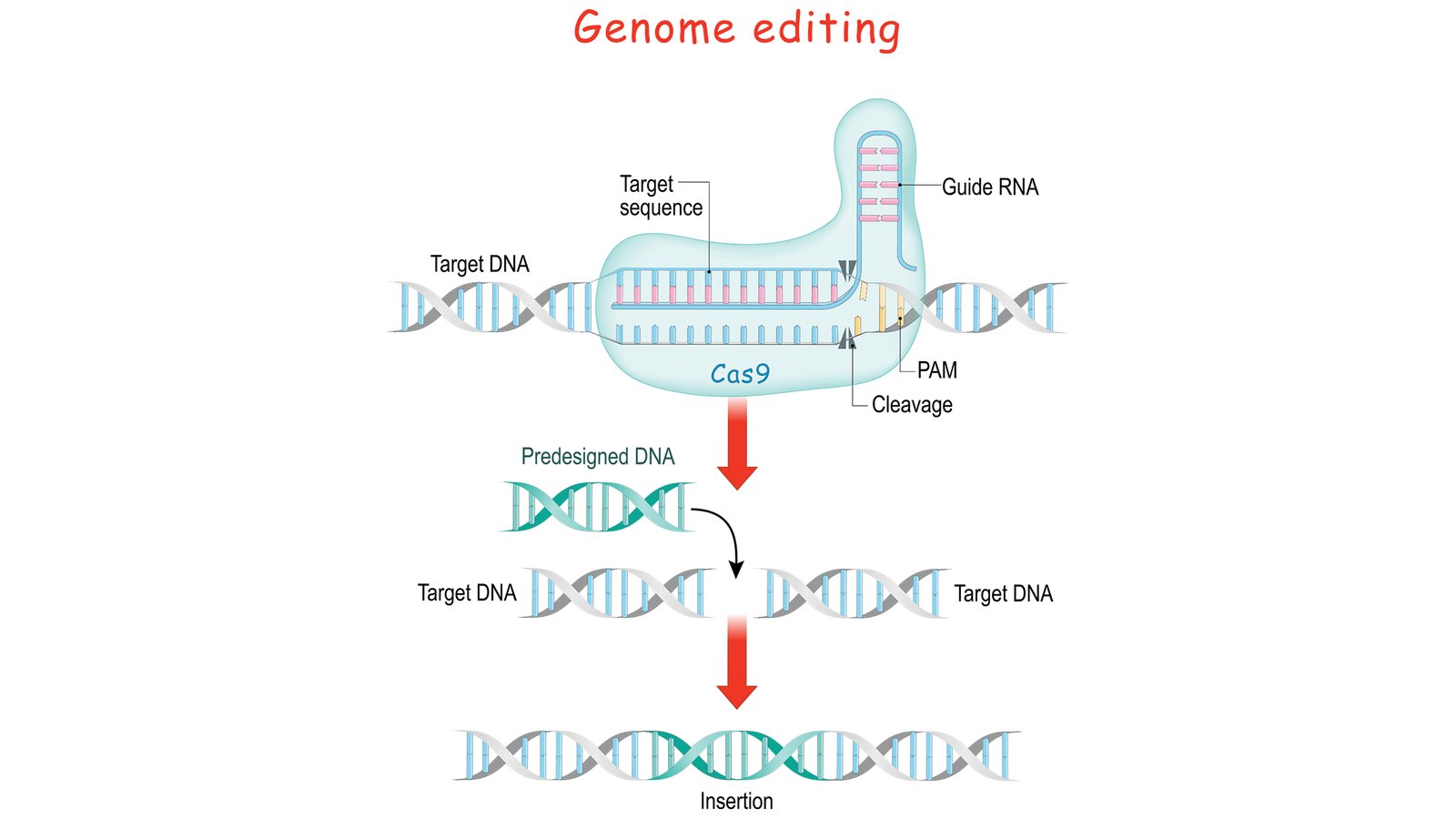
L’avenir s’annonce prometteur en ce qui concerne la thérapie génique dans son ensemble, compte tenu des nouveaux développements technologiques, notamment Édition de gènes CRISPR. Il s’agit d’une technique extrêmement puissante pour découper des parties de molécules d’ADN et même en coller de nouvelles – analogue à ce que vous faites avec du texte dans des applications de traitement de texte. CRISPR n’est pas la première méthode utilisée par les scientifiques pour modifier l’ADN, mais elle est beaucoup plus polyvalente que d’autres techniques. Ce n’est pas encore tout à fait prêt pour en direct manipulation chromosomique, mais elle progresse de façon exponentielle.
Peut-être encore plus proche de l’horizon est la perspective de fournir des charges utiles génétiques plus importantes dans les cellules. Un gros inconvénient du vecteur AAV est que chaque particule virale ne peut transporter qu’une petite quantité d’ADN, mais des recherches récentes ont révélé qu’un autre type de virus, appelé cytomégalovirus, peut être adapté pour transporter des thérapies géniques (s’ouvre dans un nouvel onglet) avec une charge utile beaucoup plus importante que l’AAV. Non seulement cela pourrait un jour étendre la thérapie génique à plus de maladies nécessitant des gènes plus gros que ce que l’AAV peut transporter, mais cela pourrait également permettre à plus d’un gène d’être administré en une seule thérapie.
[ad_2]
Source link